【摘要】 目的 建立小鼠肝细胞的体外培养方法,同时检测乙醇对肝细胞脂肪酸β-氧化速度的影响。
方法 采用戊巴比妥麻醉小鼠,通过肝脏灌注和胶原酶消化分离小鼠肝细胞,接种于胶原包被的培养皿中进行体外培养。通过HE染色观察细胞的生长状态。在20mmol/L乙醇存在的情况下,通过3H标记的棕榈酸(C16:0)检测肝细胞的脂肪酸氧化速度。
结果 成功地分离了肝细胞,肝细胞的存活率≥95%。肝细胞在体外培养48h仍能够保持良好的生长状态。对肝细胞脂肪酸氧化速度的研究发现,20mmol/L酒精能够导致肝细胞的脂肪酸氧化速度降低40%左右,导致肝细胞中脂肪含量增加。
结论 本研究成功地建立肝细胞的体外培养方法,采用3H标记的脂肪酸能够敏感地检测脂肪酸氧化速度,而研究发现乙醇能够抑制肝细胞脂肪酸氧化速度。同时,本研究结果为肝细胞的脂肪和糖类代谢的研究提供了实验条件。
【关键词】 乙醇;肝细胞;脂肪酸
The effect of ethanol on fatty acid oxidation of mice primary hepatocytes 【Abstract】 Objective To isolate the mice primary hepatocytes,and the cells were cultured in vitro.The influence of ethanol on fatty acid β-oxidation velocity was measured.
Methods The mouse was anesthetized with pentobarbital,and the liver was degested with collagenase.The primary hepatocytes were inoculated in collagen-coated dishes.The morphology of cultured primary hepatocytes was observed by HE staining.The fatty acid β-oxidation was measured using [9,10-3H] palmitic acid (C16:0) as a tracer.
Results The primary hepatocytes were isolated and cultured successfully,and the viability was more than 95%.20mmol/L ethanol could reduce the speed of fatty acid β-oxidation about 40%,and lead to the increased lipid level in hepatocytes.
Conclusion We isolated and cultured the mouse primary hepatocytes in vitro,and the influence of ethanol on fatty acid β-oxidation was determined.This study is helpful for the research on the lipid metabolism in liver.
【Key words】 ethanol;hepatocyte;fatty acid
肝脏在脂肪、糖和蛋白质的代谢过程中具有重要的作用。在体内肝细胞的代谢受到各种因素的影响。酒精在人肝细胞中主要由乙醇脱氢酶和过氧化氢酶代谢成具有细胞毒性的乙醛,然后由乙醛脱氢酶代谢为乙酸。在这个过程中,肝脏的糖脂代谢将受到影响。本研究通过体外分离肝细胞和培养,研究乙醇对肝细胞的脂肪酸氧化速度的影响。
1 材料与方法
1.1 材料 C57BL/6小鼠由第四军医大学实验动物中心提供;戊巴比妥钠、胶原酶、胰岛素、异丙肾上腺素,棕榈酸为Sigma公司;[9,10-3H]Palmitic acid为Amersham Bioscience产品;Hisafe 3闪烁计数液为PE公司产品。
1.2 肝细胞的分离 取C57BL/6小鼠,采用戊巴比妥钠(100mg/kg)麻醉;打开小鼠腹腔,向左侧移开小肠,暴露下腔静脉和门静脉,使用3号丝线从肾静脉近端绕过下腔静脉;采用21号套管针从下腔静脉传入,直至接近肝静脉;用丝线固定套管针,采用含有1mM EGTA和0.1%葡萄糖的Kreb-Ringer缓冲液灌注肝脏,同时迅速切断门静脉使灌注液从门静脉流出,灌注压力为20cm水柱,灌注速度为4ml/min;灌注20ml后更换含有0.5mg/ml胶原酶和5mM CaCl2的灌注液继续灌注10min,立刻小心取出肝脏,置于含有Kreb-Ringer缓冲液的10mM培养皿中,用剪刀剪开肝脏包膜,轻轻晃动使肝细胞释放出来;采用70μm的细胞滤器过滤;使用10%FBS的DMEM洗涤细胞2次,50×g离心。
1.3 存活性鉴定 分离后的肝细胞立刻用4%台盼蓝染色,在显微镜下观察,核呈蓝色为死细胞,拒染的细胞为活细胞,将细胞接种于胶原包被的12孔培养皿中,采用含有10%胎牛血清,100u/ml青霉素和链霉素的DMEM培养液,在5%CO2,37°C培养。
1.4 形态学观察 (1)脂肪染色:取不同培养时间的肝细胞,4%多聚醛溶液固定,油红O(Oil Red O)染色,再用苏木精衬染细胞核,缓冲甘油封片后,观察肝细胞中脂肪的含量。(2)苏木精-伊红(HE)染色:固定的肝细胞用苏木精-伊红染色,脱水透明后,观察不同生长时间的细胞形态变化。
1.5 脂肪酸氧化速度 肝细胞脂肪酸氧化速度根据文献进行[1],将分离的肝细胞接种到12孔细胞培养板中,2 ×105/孔,细胞贴壁12h后开始测定肝细胞脂肪酸的氧化速度。先用PBS洗涤细胞2次,每孔加入500μl含有0.5mg/ml BSA,22μM [9,10(n)-3H]棕榈酸 (1μCi/孔)的Hanks液,试验孔中同时加入20mM乙醇,每组3个复孔。37°C培养2h后将培养液立即转移到玻璃试管中,并采用0.5ml Hanks液洗涤细胞2次,将洗涤液也加入玻璃试管中。采用Folch法抽提脂肪酸,每管中加入8ml 甲醇/氯仿(2:1)和0.5ml 2 M KCl/2 M HCl溶液。剧烈混合30min后离心,将上层水相转移到一个新的玻璃试管中,继续采用甲醇/氯仿抽提一次,将水相转移到闪烁瓶中,加入10ml闪烁液,混合后采用闪烁计数器测定脂肪酸氧化后生成的3H2O量。肝细胞的蛋白含量采用Brad-ford法进行测定。
2 结果
2.1 分离肝细胞存活率 肝细胞分离的存活率,大于95%。
2.2 形态学观察结果 分离的肝细胞,在培养12h后即能够充分贴壁生长。肝细胞在生长的早期(24~48h)细胞状态较好,可见明显细胞极性,细胞排列生长(图1A)。细胞生长后期(>4天),肝细胞生长出现排列紊乱,细胞突触增多(图1B),并可见细胞分裂像(图1C)。
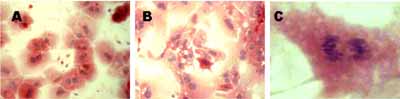 图1 体外培养的肝细胞形态
图1 体外培养的肝细胞形态
Fig 1 the morphology of cultured primary hepatocytes
A: Cultured 24 hr; B: Cultured 96 hr; C: the division the hepatocytes
2.3 乙醇对肝细胞脂肪酸氧化速度的影响 乙醇能够明显抑制肝细胞的脂肪酸氧化速度,正常培养的肝细胞脂肪酸氧化速度为3.12nmol/mg protein/h,而在20mmol/L的乙醇存在的情况下脂肪酸氧化速度为1.76pmol/mg protein/h,降低约40%左右,具体结果见图2。
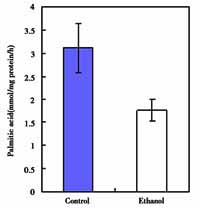 图2 乙醇对体外培养肝细胞脂肪酸氧化速度的影响
图2 乙醇对体外培养肝细胞脂肪酸氧化速度的影响
Fig 2 The effect of ethanol to the rate of fatty acid oxidation of cultured hepatocytes
2.4 肝细胞中的脂肪含量 通过油红O染色可见,肝细胞在20mmol/L乙醇存在的情况下,培养6h后,肝细胞内的中性脂肪含量明显升高,见图3。
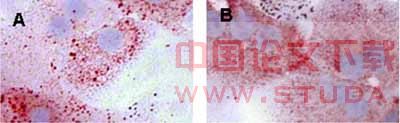 图3 20mmol/L酒精处理6h后,肝细胞的油红O染色(40×)
图3 20mmol/L酒精处理6h后,肝细胞的油红O染色(40×)
Fig 3 The Oil Red O staining of hepatocytes treated 6h with 20mmol/L ethanol (×40)
A: The hepatocytes without treating with ethanol; B: The hepatocytes treated with 20mmol/L ethanol.
3 结论
随着中国经济的发展,在西方常见的酒精性肝病(alcoholic liver disease,ALD)在我国的发病率也逐年提高。酒精为肝细胞损伤的重要因素,直接损害肝细胞线粒体、胞浆、内质网结构。酒精进入肝细胞内通过脱氢酶转变成乙醛,再通过乙醛脱氢酶(主要是线粒体酶)转换为乙酸。在此过程中氧化型辅酶I(NAD)减少,而还原型辅酶I(NADH)增多,NAD/NADH比例降低,线粒体内三羧酸循环受到抑制,使肝细胞脂肪氧化作用减弱,产生活性氧(reactive oxygen species,ROS),肝内脂肪酸合成增多超过肝脏处理能力,从而形成脂肪肝,严重者进一步发展成为酒精性肝炎和肝硬化。
乙醇在体内诱导产生“氧化应激(oxidative stress,OS)”状态,从而导致氧化还原环境的改变,一些有害活性物质的产生,金属离子的转运异常,线粒体的损害,细胞缺氧,甚至免疫系统的损害等[2~4],在细胞内数个因素相互作用导致产生氧化应激的状态。酒精导致的肝脏损害主要由于脂质过氧化,蛋白的羧基化,脂类自由基的产生,肝脏内抗氧化物质的降低[5~7],尤其是还原型谷胱甘肽(reduced glutathione,GSH)减少。酒精能够结合羟自由基(Hydroxyl Radical,酒精与羟自由基结合产生1-羟基乙基自由基(1-Hydroxyl Ethyl Radical,HER),肝脏的内质网能够依赖NADPH将酒精氧化生成HER[8]。这个过程包括通过细胞色素P450产生超氧化物和过氧化物,再通过金属催化产生羟自由基,如氧自由基,这些产物将与酒精相互作用产生HER[9,10]。从长期酒精喂养的大鼠分离的内质网相对于正常大鼠更容易产生HER,主要是由于酒精诱导CYP2E1的表达水平[11]。尽管如此,HER在酒精性肝病确切机制目前尚不清楚。一些研究认为,HER能够稳定的与蛋白质结合,从而改变蛋白的免疫源性,而导致了肝脏的损伤[12]。同时,慢性的酒精能够降低肝脏线粒体中GSH的水平,从而导致ALD的发生[13]。此外,酒精也能够抑制肝细胞的脂肪摄取,在高浓度酒精存在的情况下,线粒体ATP产生的水平也会明显降低。酒精还能够导致线粒体膜电位(ΔΨm)明显减低,导致线粒体膜的通透性的升高[14]。
本研究通过肝细胞体外培养,研究乙醇对肝细胞脂肪酸氧化速度和细胞中脂肪含量的影响,发现乙醇能够降低肝细胞脂肪酸的氧化速度,并使细胞中的中性脂肪含量增加。在肝脏功能研究过程中,最常使用的细胞系HepG2,其具有较完整的脂肪代谢相关的生物转化酶系统,因此被广泛的应用到各种研究过程中,甚至包括VLDL的分泌功能研究。但是,HepG2细胞中的生物酶系统的活性存在着明显的缺陷,也使其应用受到很大的限制。而分离培养原代肝细胞,其细胞内的生物酶活性更类似于正常生理状态,相关研究结果可直接指导临床治疗及进行预防干预。本研究结果发现,原代肝细胞对乙醇暴露具有很高的敏感性。本研究不仅为体外肝细胞的研究提供了研究材料,也为酒精性肝病的机制研究奠定了研究基础。
(致谢:本文经长安医院检验科主任,中华医学实践杂志常务编委齐为民同志审校,在此表示感谢。)
【参考文献】
1 Moon A,Rhead WJ.Complementation Analysis of fatty acid oxidation disorders.J Clin Invest,1987,79: 59-64.
2 Cederbaum AI.Introduction serial review: alcohol,oxidative stress and cell injury.Free Redic Biol Med,2003,31: 1524-1526.
3 Dianzani MU.Lipid peroxidation in ethanol poisoning: a critical reconsideration.Alcohol,1985,20:1436-1442.
4 Arteel GE.Oxidants and antioxidants in alcohol-induced liver diasease.Gastroenterology,2003,124:778-790.
5 Rouach H,Fataccioli V,Gentil M,et al.Effect of chronic ethanol feeding on lipid peroxidation and protein oxidation in relation to liver pathology.Hepatology,1997,25: 351-355.
6 Knech KT,Adachi Y,Bradford BU,et al.Free radical adducts in the bile of rates treated chronically with intragastric alcohol: inhibition by destruction of Kuffer cells.Mol Pharmacol,1995,47:1028-1034.
7 Polavarapu R,Spitz DR,Sim JE,et al.Increased lipid peroxidation and impared antioxidant enzyme function is associated with pathological liver injury in experimental alcoholic liver disease in rates fed diets high in corn oil and fish oil.Hepatology,1998,27: 1317-1323.
8 Albano E,Tomasi A,Goria-Gatti L,et al.Spin trapping of free radical species produced during the microsomal metabolism of ethanol.Chem Bio Interact,1988,1965: 223-234.
9 Reinke LA,Rau JM,McCay PB.Possible roles of free radicals in alcoholic tissue damage.Free Radic Res Commun,1990,9: 205-211.
10 Rashba-step J,Cederbaum AI.Generation of reactive oxygen intermediates by human liver microsomes in the presence of NADPH or NADH.Mol Pharmacol,1994,45:150-157.
11 Albano E,Tomasi A,Persson JO,et al.Role of ethanol-inducible cytochrome P450 (P450IIE1) in catalysing the free radical activation of aliphatic alcohol.Biochem Pharmacol,1991,41: 1895-1902.
12 Moncad C,Torres V,Varghese G,et al.Ethanol-derived immunoreactive species formed by free radical mechanism.Mol Pharmacol,1994,46:786-791.
13 Iimuro Y,Bradford BU,Yamashina S,et al.The glutathione precursor L-2-oxothiazolidine-4-carboxylic acid protects against liver injury due to chronic enteral ethanol exposure in the rat.Hepatology,2000,31:391-398.
14 Higuchi H,Adachi M,Miura S,et al.The mitochondrial permeability transition contributes to acute ethanol-induced apoptosis in rat




